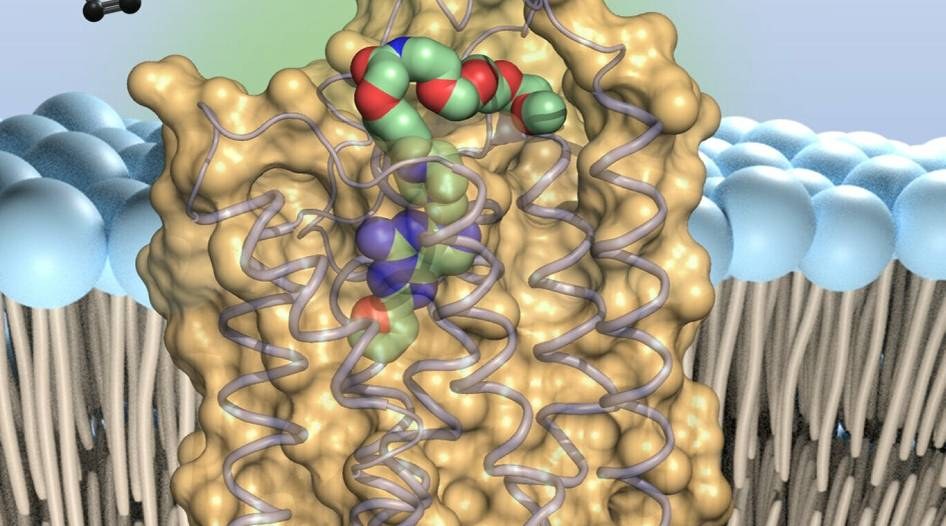
Zumindest in älteren Krimis werfen Einbrecher gerne mal ein saftiges Kotelett als Gastgeschenk über den Zaun. Darin versteckt sind ein paar Schlaftabletten oder Betäubungstropfen für den bissigen Hund. Die Juwelen der Hausherrin wechseln anschließend sehr viel ungestörter ihren Besitzer. Tumorzellen gehen oft ähnlich vor. Sie umgeben sich mit einer Wolke aus Adenosin. Als Verbindung aus dem Erbsubstanz-Baustein Adenin und Zucker ist Adenosin ein wichtiger Botenstoff im Körper. Er wirkt wie ein Schlafmittel auf die körpereigene Immunabwehr der Killerzellen, die die entarteten Krebszellen ansonsten in den Tod treiben würden. Dazu binden die Adenosin-Moleküle an winzige Antennen auf der Oberfläche der Immunzellen, die sogenannten Adenosin-Rezeptoren vom Typ 2A (kurz A2A). Sie durchspannen die Membran von Zellen. Der Teil von ihnen, der auf der Außenseite sitzt, empfängt als Sensor molekulare Signale. Wenn er das tut, stößt er mit seinem in die Zelle ragenden Anteil spezifische Reaktionen an. Dadurch werden dann etwa bestimmte Gene aktiviert. Wissenschaftler suchen deshalb seit einiger Zeit nach Molekülen, die den A2A-Rezeptor blockieren und damit die lähmende Wirkung von Adenosin verhindern können. Sie könnten damit nicht nur gegen Krebs, sondern auch gegen Hirnerkrankungen wie Alzheimer oder Parkinson zum Einsatz kommen. Pharmazeuten der Uni Bonn konnten jetzt erstmals zeigen, wie ein wichtiger Hemmstoff an den Rezeptor bindet. Professorin Christa Müller vom Pharmazeutischen Institut erklärt das Verfahren: „Wir haben den A2A-Rezeptor mit neuartigen Varianten der bekannten Hemmstoff-Substanz Preladenant versetzt. Dann haben wir aus den Rezeptor-Hemmstoff-Komplexen Kristalle gezüchtet.“ Dies sei mit Preladenant-artigen Wirkstoffen weltweit zum ersten Mal gelungen. Der Grund: Die Kristallisation dauert oft mehrere Wochen. Weil viele Preladenant-Verbindungen aber recht instabil sind, ging das Verfahren bislang immer wieder schief und brauchte einen neuen langwierigen Anlauf. Die Bonner haben deshalb den A2A-Rezeptor an einem Punkt verändert. Nun ist er deutlich stabiler. Am Preladenant konnten sie zudem mit einer Art molekularer Schnur einen Farbstoff befestigen. „So können wir kontrollieren, wo im Gewebe sich Preladenant an den A2A-Rezeptor heftet“, sagt Müller. Die Länge und Flexibilität des Nanoseils stelle zugleich sicher, dass die Bindung des Hemmstoffs an den Rezeptor nicht behindert wird. Und was hat man von Wirkstoffen in kristalliner Form? Sie lassen sich mit Röntgenstrahlen beschießen und abbilden. „Der Kristall lenkt die Strahlen ab. Aus der Art, wie er das tut, lässt sich dann auf die räumliche Struktur des Komplexes schließen – bis hin zur Anordnung einzelner Atome und ihrer Wechselwirkungen“, erläutert Tobias Claff. Der Doktorand hat den größten Teil der Experimente vorgenommen. Mit der indirekten Methode konnten Claff und seine Kollegen zeigen, an welche Punkte des A2A-Rezeptors Preladenant bindet. Mit diesem Wissen, so hoffen die Studien-Autoren, wird es nun möglich sein, den Hemmstoff gezielt so abzuwandeln, dass er gewünschte Eigenschaften bekommt. Um eine möglichst starke Wirkung zu entfalten, müssen Arzneistoffe beispielsweise gut und unverändert an den Ort gelangen, an dem sie ihren Zweck erfüllen sollen. Außerdem dürfen sie im Körper nicht zu schnell abgebaut werden. „Unsere Studie wird es deutlich erleichtern, den Wirkstoff zu optimieren“, ist Claff optimistisch. Die beiden neuen Verfahren, die Veränderung des Rezeptors und die Farbmarkierung des Hemmstoffs, könnten darüber hinaus als Vorbild für die Arbeit mit anderen Rezeptoren dienen, ist Professorin Müller überzeugt: „Die Methoden, die wir in Bonn in den letzten Jahren entwickelt haben, werden es uns in Zukunft erlauben, die Struktur solcher und weiterer Zellmembranproteine aufzuklären.“
Link zur Veröffentlichung im Journal Angewandte Chemie: Eine einzige stabilisierende Punktmutation ermöglicht hochaufgelöste Co-Kristallstrukturen des Adenosin-A2A-Rezeptors mit Preladenant-Konjugaten1
https://doi.org/10.1002/ange.202115545